التّكافؤ في الكيمياء هو العدد الذي يشير إلى قدرة عنصر كيميائي على الإتحاد مع عناصر أخرى، أي أنّها عمليّة إكتساب إلكترونات إلى إلكترونات المدار الأخير من الذّرّة، ويعرّف أيضاً في تعريف ومعنى آخر على أنّه عدد ذرّات الهيدروجين التي يمكن أن تتّحد مع أي ذرّة من عنصر ما، وله تعريف ومعنى ثالث يستند إلى عدد الرّوابط، التي تكوّنها الذّرّة مع ذرّات أخرى.
وتقاس عملية التّكافؤ بعدد الإلكترونات المكتسبة أو الفاقدة أو المتشاركة مع ذرّة أخرى لتكوين رابطة كيميائية، ويعود هذا الأمر إلى الفراغ الحجمي في المدار الأخير للنّواة، فمثلاً عناصر المجموعة الأولى في الجدول الدّوري الحديث إلكترونات التّكافؤ لها +1، أي أنّها تميل إلى فقد إلكترون واحد في المدار الأخير أو مدار التّكافؤ للوصول إلى حالة الإستقرار، وهناك مجموعات أخرى لها أكثر من رقم تكافؤ واحد تسمى بـ "الفلزات الإنتقالية".
اليوم لا يستخدم مصطلح التّكافؤ بكثرة، بل تم إستبداله بمفهوم وتعريف ومعنى آخر أكثر دقّة، هو مصطلح التأكسد والإختزال، وفي المركبات الأيونية يكون التّأكسد مساوياً لتكافؤها، أمّا بالنّسبة للمركبات التّساهمية فالأمر يختلف فهي تتضمّن عناصر لا فلزية تحتوي على فرق.
وحيد التّكافؤ
وهو مصطلح كيميائي يصف الذرّات صاحبة الكترون تكافؤ واحد فقط، أي أن عدد التّكافؤ لها هو 1، وبالتالي إلكترون واحد في المدار الخارجي الأخير، وهي عناصر المجموعة الأولى من عناصر الجدول الدّوري الحديث، وكمثال عليها: ذرّات الصّوديوم والبوتاسيوم، ونظراً لإحتوائها على إلكترون واحد في مدرها الخارجي فإنّه من السّهل عليها أن تفقده في تفاعلات كيميائية للوصول إلى حالة الإستقرار، لهذا فإنّه من النادر أن نجد هذه العناصر الطبيعية منفردة، ولكن تكون نشطة ومرتبطة مع أيون عنصر أو جزيء آخر، وأبسط مثال على هذا هو تفاعل الصّوديوم مع الكلور لتكوين كلوريد الصوديوم NaCl أو ما يعرف باسم ملح الطعام.
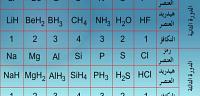
تكافؤ العناصر بالنّسبة إلى الهيدروجين
العناصر الموجودة في الجدول الدّوري من المجموعة الأولى حتى السابعة لها نظامين من التّكافؤ هما:
- التّكافؤ = رقم المجموعة.
- التّكافؤ = 8-رقم المجموعة.
وأحياناً نجد أن لنفس العنصر أكثر من تكافؤ، ولكن يعتمد له في هذه الحالة رقم التّكافؤ الأصغر، أمّا بالنّسبة للمجموعة الثّامنة من عناصر الجدول الدوري ليس لها إلكترونات تكافؤ؛ لذلك فإنها لا تدخل في اى تفاعل كيميائي مع عناصر أخرى؛ وذلك لأنّها خاملة كيميائيّاً بسبب إستقرار أنويتها وإكتمال جميع مداراتها بعدد الإلكترونات الكامل، ويطلق عليها اسم الغازات الخاملة أو النّبيلة.
ثنائي التّكافؤ
وكتطبيق عملي على ما تم ذكره من قواعد وشروط، ستأخذ جزيء الماء كمثال عليه:
يتكون جزيء الماء من ذرّتين من الهيدروجين، وذرّة واحدة من الأكسجين، وذلك لأن:
- يعتبر الهيدروجين من عناصر المجموعة الأولى وبالتّالي فإنّ إلكترونات التّكافؤ لها =1
- أمّا الأكسجين فإنّه من عناصر المجموعة السّادسة، وبالتّالي فإنّ إلكترونات التّكافؤ لها =8-6=2
وبالتّالي تتحد ذرّتين من الهيدروجين مع ذرّة واحدة من الأكسجين لتكوين جزيء الماء.