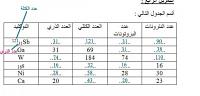
العدد الذري هو واحد من أهم وأبرز المصطلحات التي اقترنت بعلمي الفيزياء والكيمياء، حيث يعبر هذا المصطلح عن عدد البروتونات التي تتواجد في داخل نواة ذرة العنصر. يمكن اعتبار أن العدد الذري والمتواجد في جدول مندليف الدوري يمثل عدد جميع العناصر التي تتواجد في الجدول الدوري نفسه. فعندما أراد مندليف ترتيب العناصر الكيميائية في الجدول الدوري قام بالاعتماد على مفهوم وتعريف ومعنى الكتلة الذرية ليرتب هذه العناصر وفقاً لتطابقها في الخصائص الكيميائية التي تمتلكها هذه العناصر، مما أدى إلى بروز وظهور العديد من الأخطاء، فإذا ما تم الاعتماد على مفهوم وتعريف ومعنى كتلة الذرة فإن أماكن وجود هذه العناصر في الجدول الدوري سيكون خاطئ، أما في حالة تم ترتيب العناصر الكيميائية في جدوله الدوري وفقاً للعدد الذري فإن النتيجة ستتطابق حتماً مع التصنيف وفق الخصائص الكيمائية، مما دفعه إلى الاعتماد على العدد الذري في ترتيبه للعناصر الكيميائية عوضاً عن اعتماده على كتلة العناصر الكيميائية في ترتيب هذه العناصر. فالعدد الذري لعنصر الهيدروجين هو ( 1 ) وتحتوي نواة هذا العنصر على بروتون واحد فقط، في حين أن العدد الذري الخاص بعنصر الهيليوم يساوي ( 2 ) حيث أن نواة الهيليوم تحتوي على بروتونين ونيوترونين اثنين أيضاً، أما عنصر الليثيوم ذو العدد الذري ( 3 ) فإنه نواته تحتوي على عدد بروتونات يساوي الثلاثة في حين تحتوي على 4 نيوترونات.
من الملاحظ أنه إذا تساوت أعداد النيوترونات والبروتونات في النواة فإن الشحنة لهذه النواة تكون شحنة متعادلة، وهذا ينطبق على العشرين عنصر الأوائل في ترتيب مندليف الموضح في جدوله الدوري وبعد العنصر رقم ( 20 ) ستحتاج النواة إلى عدد أكثر من النيوترونات حتى تستقر هذه النواة، والنواة غير المستقرة هي النواة التي تتميز بوجود نشاط إشعاعي فيها.
ولمعرفة العدد الذري للعنصر فإنه يكون مكتوباً في الجدول الدوري تحت رمز ذلك العنصر في حين أن الرقم الذي يكتب فوق العنصر يمثل العدد الكتلي لهذا العنصر، و إن علمنا أن الذرة هي ذرة متعادلة فإن عددها الذري يساوي عدد البروتونات ذوات الشحنة الموجبة ويساوي أيضاً عدد الإلكترونات ذوات الشحنات السالبة. في حين يمكن حساب العدد الكتلي عن طريق جمع عدد النيوترونات مع عدد البروتونات، فمثلاً إذا كان العدد الذري لذرة الصوديوم 11 وعددها الكتلي 23 فهذا يعني أن عدد البروتونات فيها وعدد الإلكترونات يساويان 11 أيضاً أما عدد النيوترونات فتكون 12 وهو ناتج طرح عدد البروتونات من العدد الكتلي.