المادّة
يحتوي الكون على الكثير من المواد المختلفة مثل: المواد السائلة والصلبة والغازية بمختلف الأشكال والأنواع، والمادّة Matter هي كلّ شيء له كتلة وحجم، والمادّة لها حجم وكثافة وطاقة وكتلة، وكثيرٌ من علماء الفيزياء قاموا بدراسة المواد وما تحتويه في تركيبها، وقام العلماء أيضاً بقياس كميّة المواد؛ فعالم المواد هو متشعّبٌ وكبيرٌ جداً؛ لهذا سوف نتطرّق خلال هذا المقال بالتفصيل إلى تعريف ومعنى المادة، وحالاتها، وكيفيّة قياسها.
تعريف ومعنى المادّة
المادة هي كلّ ما يحيط بالإنسان سواءً كانت ملموسةً أو غير ملموسة، ولكن يمكن إدراكها والتعرّف عليها، وعادةً تكون لها كثافةٌ وكتلةٌ وشكلٌ إن كانت طبيعيّة أو صناعيّة، وكلّ مادّةٍ تتكوّن من جزئيّات صغيرة جداً، لا يمكن رؤيتها بالعين المجردة، ولكن بفحصها مخبريّاً، والجزئيات تتكوّن من جسيمات صغيرة جداً وهي الذرّات.
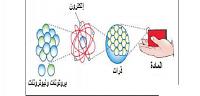
قام العلماء بدراسة الذرّات، وتمّ إدراك وجود جسيمات أصغر منها، وهي الجسيمات الأوليّة التي تنقسم إلى الكواركات؛ وهي عبارةٌ عن البروتونات والنيوترونات، واللبتونات وهي تتكون من الإلكترونات، وأخيراً البوزونات وهي جسيمات ثقيلة بمائة مرة من وزن البروتونات، وكلّ مادة في الطبيعة لها عددٌ مختلفٌ من الذرات، وبالتالي تختلف من حيث عدد الإلكترونات والنيوترونات والبروتونات.
حالات المادة
- الحالة الصلبة: وهي الحالة التي تكون مكونات المادة قريبة جداً، ومترابطة فيما بينها، فقوّة الترابط ما بين الذرّات أو الجزيئات تكون كبيرةً جداً، لا يمكن تحريكها بسهولة، والمادة في هذه الحالة لها شكلٌ معينٌ مثل الحجارة والأخشاب لا يمكن تغييرها بسهولة، ولكن يمكن تشكيلها بصعوبة تحت ظروف معينة، ونذكر أنّ الذرّات في المادة الصلبة تتحرك وتهتز باستمرار، ولكن هذه الحركة لا يمكن رؤيتها.
- الحالة السائلة: يعتبر الماء مثالاً واضحاً على الحالة السائلة؛ فالحالة السائلة أقلّ تماسكاً من الصلبة؛ وذلك نتيجة قدرة الذرّات على التدفّق والحركة بسهولة نتيجة ضعف قوة الترابط بينها، والحالة السائلة ليس لها شكل ثابت، ولكن يمكن أن تتّخذ شكل الوعاء الذي توجد به، والسوائل لها لزوجةٌ مختلفةٌ عن بعضها البعض.
- الحالة الغازية: الهواء هو الحالة الغازية الشائعة في الكون؛ ففي الحالة الغازية تتحرك الذرّات بحركة عشوائيّة وبحريّة تامّة، والغازات لا تمتلك شكلاً وحجماً مثل المادة الصلبة أو السائلة، ولكن يمكن ضغطها في وعاء مثل البالونات والإطارات وغيرها.
- البلازما: هي غازات متأيّنة مثل البرق وسطح الشمس، والبلازما عبارةٌ عن مادة تكون فيها الإلكترونات حرةً غير مرتبطة بالبروتونات والنيترونات، وتحدث البلازما عند تعريض حرارة وطاقة مُعيّنة إلى غاز، فيخرج منها إلكترون أو أكثر، وهذا ما يؤدّي إلى تكوّن البلازمات أو الغازات المتأينة.
قياس المادّة
المول
تقاس المادة بالمول، وهي عبارة عن وحدة من وحدات الكيمياء، والمول هي كلمة ألمانية استخدمها العالم الألماني فيلهلم أوستفالد عام 1893م من الكلمة الألمانية Mol وهي عبارة عن جزيء، ووحدة المول معتمدة عالمياً في النظام الدولي للوحدات، وتعريف ومعنى المول هو كتلة المادة بالغرام لجزيء المادة.
والمول هو ما تحتويه المادّة من عدد الجسيمات؛ فمثلاً الأكسجين يتكون من ذرّتين ووزن كل ذرّة 16 غراماً، فوزن الذرّتين يكون هو 32 غراماً؛ إذن فكلّ واحد مول من الأكسجين عبارة عن 32 غراماً، وذرّة الكربون هي 12 غراماً، فمول واحد من الكربون هو 12 غراماً، وأمّا الماء يتكون من أكسجين وهيدروجين، فيتمّ قياس وزن وجزيئات الذرّات فيه.
الكتلة الموليّة
وهي عبارة عن وزن الجسيمات في المادّة، فإذا كانت المادّة تتكون من ذرات؛ فالكتلة الموليّة هي الذرّات بالغرام، وأما إذا كانت تتكون من جزيئات؛ فيتم احتساب وزن عدد الذرّات المختلفة للجزيء بالجرام مثل جزيء الماء، والكتلة الموليّة هي عبارة عن عدد الأيونات في المادّة؛ فمول واحد من الحديد هو مول واحد من الذّهب؛ أي طن واحد من الحديد يساوي طناً واحداً من الذهب في الوزن، ومول واحد من الماء يساوي مولاً واحداً من القطن وهكذا.
الجدول الدوري للعناصر
يوجد في الكيمياء ما يسمّى بالجدول الدوري للعناصر، وهو خلاصة الكتل المولية لجميع العناصر المكتشفة في الطبيعة، فمثلاً لقياس مادّة الصخر أو الحجارة لا بُدّ من معرفة جميع العناصر التي تتكوّن منها، ومن ثمّ أخذ قيم هذه العناصر من الجدول الدوري الخاص بها، وبعدها يتمّ احتساب الكتلة الموليّة للمادة، والعناصر تتكوّن من عدد النظائر أحياناً؛ فمثلاً عنصر الحديد يحتوي على عدد كبير جداً من النظائر، ولكن أكثرها شيوعاً هي أربعة أنواع ، فباحتساب وزن النظائر يمكن معرفة العدد الذري لعنصر الحديد.
عدد أفوجادرو
كميّة المادة هي عبارة عن عدد الجزيئات أو الذرات فيها؛ أي وزن أيّ عنصر هو الوزن الذرّي له، ويكون عادةً مثبتاً في الجدول الدوري، والوزن الذرّي قيمة ثابتة لوزن البروتونات والنيترونات للذرّة، والقيمة الثابتة هي القيمة التي اكتشفها العالم أوجادرو، وسمّيت بثابت أفوجادرو وتساوي ( 6.02 × 10²³ ) بالغرام، فمول واحد يساوي عدد أو ثابت أفوجادرو. ويمكن استنتاج قانون احتساب المول ويساوي: المول = عدد الجسيمات ÷ عدد أفوجادرو، عدد الجسيمات = المول × عدد أفوجادرو.
مثال على قياس المادة
- قياس مادة الماء: يتواجد الماء أو جزيء الماء على الصيغة التالية H2O؛ أي إنّه عبارة عن اتحاد ذرتين من الهيدروجين بذرّة واحدة من الأكسجين، والوزن الذرّي للأكسجين هو عبارة عن 16، والوزن الذرّي للهيدروجين هو 1؛ فلدينا فعلياً 16 جراماً من الأكسجين وغرامين من الهيدروجين، وفعلياً 18 غراماً في ثابت عدد أفوجادرو أي 18× 6.02 × 10²³ جرام.
- قياس مادة الهيلوم: غاز الهيليوم هو من الغازات الخفيفة جداً؛ فهو أحادي الذرّة، والوزن الذري للهيليوم هو العدد 4؛ أي يتكون من بروتونين ونيوترين، فمول واحد من الهيليوم هو عبارة عن 4 جرام × ثابت العدد أفوجادرو.
كتلة المادة
لا بدّ من الإشارة أنه عند قياس أيّ مادة يجب قياس كتلتها باستخدام الأوزان المشهورة؛ فالوزن يقاس بوحدة نيوتن وأمّا الكتلة تقاس بالجرامات، ومن أشهر وحدات القياس الرّسمية للكتلة هو الطن ويساوي مليون جرام، والكيلو يساوي ألف جرام، والجرام يساوي واحد جرام.
ونشير أيضاً إلى أنّ الوزن هو مقدار جاذبية الأرض للجسم، كما عرّفها العالم الفيزيائي المعروف نيوتن، ولكن تعرف ما هو شائع هو اعتبار قياس كتلة أيّ مادة عبارة عن وزنها، ولكن الأدق هو أنّ الكتلة مقدار ما تحتويه المادة من حجم وقوّة وطاقة بين جسيماتها، وهذا هو فعليّاً قياس كتلة المادة.
من المهم التفريق بين الحجم والكثافة؛ ففي حديثنا عن الحجم نبيّن بأنّه ما يشغله الجسم في الفراغ حسب كميّة المادة، والكثافة هي مقدار تركيز المادة في هذا الحجم الذي يشغله الجسم، ومن البديهي لمعرفة كتلة المادة أنّه يجب معرفة حجمها وكثافتها؛ فالكتلة والحجم والكثافة مرتبطة مع بعضها بالكامل، وأدوات قياس كتلة المادة متعددة، ومن أهمّها الميزان المدرج؛ حيث يوضع الجسم على الميزان، ويتمّ احتسابه حسب دوران المؤشّر إذا كان الميزان إلكترونياً، ويُقاس أيضاً بالوزن العادي، وتمّ إيجاد قوانين خاصّة بقياس الكتلة، وهي بمعرفة الوزن أي مقدار الجاذبية الأرضيّة التي تؤثر على الجسم مقسوماً على تسارع الجاذبية الأرضية، وهو مقدار ثابت ويساوي 9.8م/ث2 .