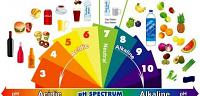
نستطيع عندما نقوم بتذوّق الليمون أو بعض المواد الأخرى بالإحساس بطعم الحموضة، كما وتتسبب لنا مواد أخرى بالحروق أو الكيّ للجلد وغيره، ويرجع السبب في ذلك لخاصيةٍ كيميائيةٍ موجودةٍ في المواد وهي درجة الحموضة أو كما تعرف (PH) أو كما تُعرف أيضاً بالأس الهيدروجيني، فتقوم هذه الخاصيّة بوصف المادّة على أساس أنها قاعدية، أو حمضية، أو متعادلة عن طريق التدرّج من العدد ( 1 - 14) بحيث يكون المحلول الذي يحمل الرقم 7 متعادلاً كما في الماء النقي، بينما تكون المحاليل الأقل من ذلك حمضيّة بحيث تزداد درجة حموضتها كلّما قلّ الرقم، وتكون المواد ذات الرقم الأعلى من ذلك قاعدية فتزداد قاعديّة المحلول كلما زاد الرقم.
وتسمى درجة الحموضة أيضا بالأس الهيدروجيني، وذلك لأنّه يمكن حسابها عن طريق سالب لوغاريثم تركيز أيون الهيدروجين في المحلول، ويرجع استخدام مصطلح (PH) في حسابات درجة الحموضة إلى عام ????، حيث قام العالم سورين سورينسن باستخدامه، وأصبح فيما بعد الحرف (H) يعبّر عن الهيدروجين والحرف (P) يعبّر عن الأس.
وتختلف المواد الحمضيّة عن المواد القاعديّة بشكلٍ كبيرٍ جداً، فالمواد الحمضيّة تعتبر هي المواد الأكثر شهرةً بين الناس وهذا بسبب استخداماتها في الطعام، حيث تتميّز هذه المواد بطعم لاذع كطعم الليمون والذي يعتبر أحد المواد الحمضيّة الخفيفة التركيز ولهذا يمكن لنا تناوله، كما تتميّز المواد الحمضيّة بخصائص أخرى وذلك في حال تفاعلها مع المواد المعدنية لتعطي الأملاح، إلّا أنّ المواد الحمضيّة والمواد القاعديّة عندما تتفاعل مع بعضها البعض تتعادل فتعطب الماء والأملاح، ولهذا يُنصح عند الشعور بالحموضة في المعدة والتي تحدث نتيجة لارتفاع الأحماض الموجودة في المعدة إلى المريء بتناول بعض المواد القاعديّة كالخيار على سبيل المثال.
تمتاز المواد القاعدية بدرجة حموضةٍ أعلى من سبعة، والتي ربما تعتبر أشهرها هي الصودا الكاوية المستخدمة في صناعة الصابون، والأوراق، والتنظيف، والتي تعتبر من أقوى المواد القاعدية أيضاً، ولذلك يعتبر التعامل مع هذه المادة أمراً خطراً وذلك بسبب الخصائص القاعديّة التي يمتلكها، فتعتبر المواد القاعديّة مواداً حارقةً وكاويةً للجلد، كما أنها تعتبر صابونية الملمس عند لمسها للجلد، وتعتبر موصلة للكهرباء عند انحلالها في الماء كما في الأحماض أيضاً، ويمكن الكشف عن ما إذا كانت المادة تحمل درجة حموضة أقل أو أعلى من سبعة عن طريق ورقة عباد الشمس التي تتحوّل للون الأحمر عند ملامستها للأحماض وللّون الأزرق عند ملامستها للقواعد.